b 型流感嗜血杆菌结合疫苗目前我国内地没有,需要接种可以通过鲸苗网预约,前往香港接种。
(一)
b型流感嗜血杆菌结合疫苗说明书
核准日期:2014年04月22日
修改日期:2015年04月13日、2017年11月28日、2018年05月29日、2020年04月12日、2020 年05月25日、2020年07月01日、2021年04月27日、2021年07月08日、2022年01月26日、2022年06月01日 、2023年11月15日
请仔细阅读说明书并在医师指导下使用
【药品名称】
通用名称:b 型流感嗜血杆菌结合疫苗商品名称:安尔宝®,Act-HIB®
英文名称:HAEMOPHILUS TYPE b CONJUGATE VACCINE
汉语拼音:b Xing Liugan Shixue Ganjun Jiehe Yimiao
【成份和性状】
1个免疫剂量含:
- 冻干粉剂:
–b 型流感嗜血杆菌* 多糖…10 µg**
— 结合破伤风蛋白……18-30µg
— 缓血酸胺
— 蔗糖
— 浓盐酸(用于调整pH值)
* IM2164 株
** 相当于纯化多糖含量 - 稀释液:
— 氯化钠
— 注射用水…加至0.5 ml
性状:白色均质粉状或块状疏松体,溶解后无色澄明。
【接种对象】
2月龄婴儿~5周岁儿童。
【作用与用途】
本疫苗接种后,可使机体产生体液免疫应答。用于预防由b型流感嗜血杆菌引起的侵袭性感染(脑膜炎、肺炎、败血症、蜂窝织炎、关节炎、会厌炎等)。
本疫苗不能预防其它类型流感嗜血杆菌引起的感染,也不能预防其它病原体引起的脑膜炎等。
【规格】 10μg/支(含预充型注射器装稀释液0.5ml/支)。
【免疫程序和剂量】
使用本疫苗预充型注射器内装的稀释液溶解冻干粉剂,需充分摇匀至完全溶解。 预充型注射器若无附带针头,独立包装的针头必须旋转1/4后牢固安装在注射器上。
用法:
肌肉或深度皮下注射,严禁静脉注射。
- 对婴幼儿及低龄儿童,建议注射部位选在大腿前外侧(中间三分之一处)。
- 对大龄儿童,建议注射部位选在上臂三角肌区域。用量:
- 小于6月龄婴儿,自2或3月龄开始:0.5ml/ 剂,间隔1或2个月,连续接种三剂,在第3 次接种后一年(建议第18月龄),加强接种一剂(0.5ml)。
- 6-12月龄婴儿:0.5ml/ 剂,间隔1或2个月,连续接种二剂,建议于第18月龄加强接种一剂(0.5ml)。
- 1-5 岁儿童:接种一剂(0.5ml)。
【不良反应】
以下安全性信息来自于本疫苗单独使用,与含有白喉、破伤风和(全细胞或无细胞)百日咳成分的疫苗联合使用,或制成联合疫苗使用,包括上市前的临床试验和上市后的监测。
- 临床试验
共计约7000多名2岁以下健康儿童的临床试验,几乎均为与(全细胞或无细胞)白百破疫苗(DTP)联合接种。与首剂次相比,本疫苗基础免疫程序中后续剂次的局部或全身反应发生率和严重程度未见增加。
发生率超过1%的不良反应一般出现在接种后6~24小时,且大多为一过性的轻度到中度反应。
按照国际医学科学组织委员会(CIOMS)推荐的分类(根据系统器官和频率分类)描述本疫苗临床试验中观察到的不良反应发生率:十分常见(≥10%),常见(1%-10%,含1%), 偶见(0.1%-1%,含0.1%),罕见(0.01%-0.1%,含0.01%),十分罕见(<0.01%)。 1)全身及注射部位:
- 十分常见到常见:注射部位疼痛、红斑、肿胀和/或发炎、硬结等。
- 常见:发热。
– 偶见:发热(> 39℃)。
- 代谢及营养失调
- 十分常见:食欲不振。
- 精神/神经系统:
- 十分常见:易激惹、嗜睡。
- 常见到偶见:哭闹(不可控或异常哭闹)。
- 消化系统:
- 常见:呕吐。
- 上市后监测
本疫苗上市后发现以下自发报告的不良事件,在时间上与接种疫苗有关联,发生频率多为不详(从现有数据无法估算)。
- 全身及注射部位:
-注射部位大于 5cm 的反应,如红斑、水肿和/或发炎,或者注射部位硬结和疼痛等。
-接种肢体的水肿(可能蔓延到整个肢体);单侧或双侧下肢水肿(接种后最初几小时内出现,24小时内迅速自行缓解,没有后遗症,可能伴有发绀、红斑、一过性的紫癜和严重哭闹,主要见于基础免疫剂次后的报告)。 - 免疫系统:速发型过敏反应,如面部水肿和喉水肿。
- 神经系统:伴有或者不伴有发热的惊厥。
- 皮肤和皮下组织:荨麻疹、皮疹、瘙痒、全身性皮疹。
特殊人群: 极早早产儿(胎龄不超过28周)可能出现呼吸暂停(详见【注意事项】)。
【禁忌】
- 对本疫苗中的活性物质、任何一种辅料、破伤风类毒素或者甲醛(每剂中可能有痕量残留)过敏者。
- 已知既往接种 b 型流感嗜血杆菌结合疫苗后出现过敏反应者。
- 在发热或急性疾病期间,应该推迟进行接种。如有疑问请向负责接种的医务人员咨询。
【注意事项】
- 本疫苗不得经血管内途径注射。
- 与所有注射用疫苗一样,由于注射后可能出现速发型过敏反应,应提前做好救治准备。应备有肾上腺素等药物,以备偶有发生严重过敏反应时急救用。接受注射者在注射后应在现场观察至少 30 分钟。
- 接种本疫苗前应进行病史筛查(特别是既往疫苗接种史和接种后出现的不良事件)及临床查体。
- 与所有注射用疫苗一样,本疫苗应谨慎用于患有血小板减少症或凝血障碍者,因为肌肉注射后可能存在出血风险。
- 患有先天性或获得性免疫缺陷的儿童接种本品后的免疫应答可能偏低。对于正在接受免疫抑制剂治疗(皮质类固醇、抗有丝分裂的化疗等)的儿童,推荐在治疗结束后再行接 种。
- 对胎龄不超过 28 周的极早早产儿进行基础免疫接种时,应考虑呼吸暂停的潜在风险以及进行 48-72 小时呼吸监测的必要性,尤其是对呼吸系统发育不成熟病史的婴儿。因此类婴儿可从本疫苗的接种中获益,故不应拒绝或延迟免疫接种。
- 在任何情况下,本疫苗中的破伤风类毒素不能代替常规破伤风类毒素的免疫接种。
- 如果本疫苗同其它疫苗,如:麻风腮联合疫苗、百日咳、白喉、破伤风、脊髓灰质炎疫苗,同时接种时应在不同部位分别接种。
- 务必置于儿童不能触及处。
- 预充型注射器的针头护帽含有天然乳胶衍生物,对乳胶敏感者接种本品可能会出现过敏反应。
- 由于对针头注射的心因性反应,受种者可能在任何注射类疫苗接种前/后发生晕厥(晕针)。需采取措施处理晕厥反应并防止跌倒造成的伤害。
如有疑问请咨询负责接种的医务人员。
【药物相互作用】
为了避免不同医用制品间可能发生的相互作用,接种本疫苗时任何正在进行的其它治疗均应向负责接种的医务人员报告。
【贮藏】 本制剂应保存在 2℃~8℃(在冰箱内)。 不得冷冻。
【包装】
1 瓶 1 剂量冻干粉剂(10 µg) + 1 支预充型注射器装稀释液(0.5 ml)。
1 瓶 1 剂量冻干粉剂(10 µg)+ 1 支无附带针头预充型注射器装稀释液(0.5 ml)+ 2 个独立包装的针头。
1 支/盒,10 支/盒。
【有效期】 36 个月。
【执行标准】进口药品注册标准: JS20210022
【批准文号】
进口药品注册证号:S20140013
进口分包装文号:国药准字 J20140173
【药品上市许可持有人】名称:SANOFI PASTEUR
注册地址: 14 Espace Henry Vallee 69007 LYON, France
【生产企业】
企业名称:SANOFI PASTEUR
生产地址:1541 avenue Marcel Merieux, 69280 MARCY L’ETOILE, France
电 话:+33 (0) 4 37 37 01 00
传 真:+33 (0) 4 37 37 78 30
网 址:www.sanofi.com/en 国内联系方式:
深圳赛诺菲巴斯德生物制品有限公司电 话:010-65685588
传 真:010-65668348,65669783
网 址:www.sanofi.cn
疫苗接种咨询热线:800-810-7100, 400-650-9932
深圳赛诺菲巴斯德生物制品有限公司分包装
分包装地址:深圳市坪山新区锦绣东路 25 号赛诺菲巴斯德生命科学园区邮编:518122
(二)
b型流感嗜血杆菌结合疫苗产品包装




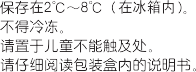
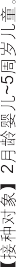
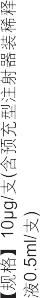
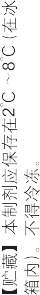
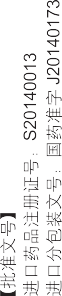

(三)
b型流感嗜血杆菌结合疫苗产品内标签

(四)
b型流感嗜血杆菌结合疫苗产品信息表
| 序号 | 项目名称 | 品种信息 | 备注 |
|---|---|---|---|
| 1 | 药品通用名称 | b 型流感嗜血杆菌结合疫苗 | |
| 2 | 药品英文名称 | HAEMOPHILUS TYPE b CONJUGATE VACCINE | |
| 3 | 药品商品名称 | 安尔宝/Act-HIB | |
| 4 | 剂型 | 注射剂 | |
| 5 | 制剂规格 | 10μg/支(含预充型注射器装稀释液 0.5ml/支) | |
| 6 | 包装规格 | 1 支/盒,10 支/盒。 | |
| 7 | 适应症 | 本疫苗适用于 2 月龄婴儿~5 周岁儿童预防 b 型流感嗜血杆菌引起的侵袭性感染(脑膜炎、肺炎、败血症、蜂窝织炎、关节炎、会厌炎等。 | |
| 8 | 用法用量 | 用法:肌肉或深度皮下注射,严禁静脉注射。对婴幼儿及低龄儿童,建议注射部位选在大腿前外侧(中间三分之一处)。对大龄儿童,建议注射部位选在上臂三角肌区域。用量:小于 6 月龄婴儿,自 2 或 3 月龄开始:0.5ml/ 剂,间隔 1 或 2 个月,连续接种三剂,在第 3 次接种后一年(建议第 18 月龄),加强接种一剂(0.5ml)。6-12 月龄婴儿:0.5ml/ 剂,间隔 1 或 2 个月,连续接种二剂,建议于第 18 月龄加强接种一剂(0.5ml)。1-5 岁儿童:接种一剂(0.5ml)。 | |
| 9 | 药品有效期 | 36 个月 | |
| 10 | 药品批准文号 | 国药准字 J20140173 | |
| 11 | 进口药品注册证号 | S20140013 | |
| 12 | 进口/国产药品批件号 | 2020S01095 | |
| 13 | 疫苗上市许可持有人 | 赛诺菲巴斯德 | |
| 14 | 生产企业名称 | 赛诺菲巴斯德 |
| 15 | 统一社会信用代码(生产企业) | 91440300618914306M | |
|---|---|---|---|
| 16 | 进口疫苗代理企业名称 | 深圳赛诺菲巴斯德生物制品有限公司 | |
| 17 | 统一社会信用代码(进口疫苗代理企业) | 91440300618914306M | |
| 18 | 公司名称(中文) | 赛诺菲巴斯德 | |
| 19 | 公司名称(英文) | SANOFI PASTEUR | |
| 20 | 生产厂名称(中文) | 赛诺菲巴斯德 | |
| 21 | 生产厂名称(英文) | SANOFI PASTEUR |